
生命科学学院 新闻动态
N6-甲基腺苷(m6A)广泛分布于哺乳动物的mRNA中,在多种重要的生命活动和特定的病理过程中发挥着至关重要的作用。然而,在胚胎早期发育过程中,m6A及其相关蛋白所行使的确切功能仍然没有被完全阐明。尤其是在人源体系上,目前仍然缺少关于m6A去甲基化酶在胚胎发育早期阶段的作用研究。ALKBH5是迄今为止被发现的第二种(m6A)去甲基化酶。虽然已有大量的研究证据先后揭示了ALKBH5在各类肿瘤发生发展以及多种疾病过程中的重要调控作用,但早年间的研究发现ALKBH5在正常的生理条件下所发挥的功能似乎十分有限。
从2021年开始,研究人员以多能干细胞为体外诱导模型,陆续揭示了ALKBH5在心脏细胞定型以及胰腺类器官形成等方面上的作用,为ALKBH5在早期胚胎发育过程中的研究提供了重要的研究基础。更重要的是,这些工作证明了ALKBH5在正常生理条件下同样能发挥关键的调控作用。然而,目前关于ALKBH5在胚胎发育上的研究基本都是关于成熟体细胞的终末端分化或者成体干细胞代谢等方面,而我们对ALKBH5在胚胎发育早期阶段的细胞命运调控作用仍然知之甚少。
近日,西湖大学裴端卿团队在Nucleic Acids Research发表题为“ALKBH5 Governs human Endoderm Fate by Regulating the DKK1/4-mediated Wnt/β-catenin Activation”的研究论文,该研究首次揭示了ALKBH5在人体外早期内胚层发育过程中的调控作用及其分子机制,并系统地阐述了“ALKBH5-GATA6-DKK1/4-Wnt/β-catenin”这条对于早期内胚层命运决定不可或缺的调控路线。此外,这项工作还报道了经典Wnt通路负向调节因子DKK1/4在该体系中对Wnt/β-catenin信号通路的新型调控模式。
文章截图:

原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae707/7738000?login=true
01. ALKBH5的缺失严重阻碍人定形内胚层的发育
胚胎干细胞的多能性维持和早期三胚层分化一直以来都是胚胎发育早期极具代表性的细胞命运调控事件。囊胚内细胞团中的胚胎干细胞具有多能性和自我更新能力,在胚胎原肠形成时期能够在特定细胞信号的驱动下逐渐特化和迁移,并分化为三个主要的早期胚层——外胚层、中胚层和定形内胚层(早期内胚层)。为探索ALKBH5在胚胎发育早期细胞命运决定上的作用,裴端卿团队构建ALKBH5敲除人胚胎干细胞系,并初步检测ALKBH5的敲除对多能干细胞维持和早期三胚层分化能力的影响。研究人员发现,ALKBH5缺失细胞诱导分化的定形内胚层标志基因均无法正常上调。
基于以上结果,研究人员决定通过化学成分明确的定形内胚层诱导方案进一步验证ALKBH5敲除对早期内胚层形成的影响。背景复杂度(context-complexities)一直是左右m6A相关蛋白功能研究的重要因素。因此,鉴于m6A相关蛋白功能的背景依赖性(context-dependent),研究人员选择了由Activin A单独诱导的定形内胚层分化方案,并用于后续的绝大部分验证实验。借助该诱导体系,裴端卿团队从分化细胞形态以及标志物的表达上更加确切地观测到ALKBH5敲除细胞的定形内胚层分化障碍。
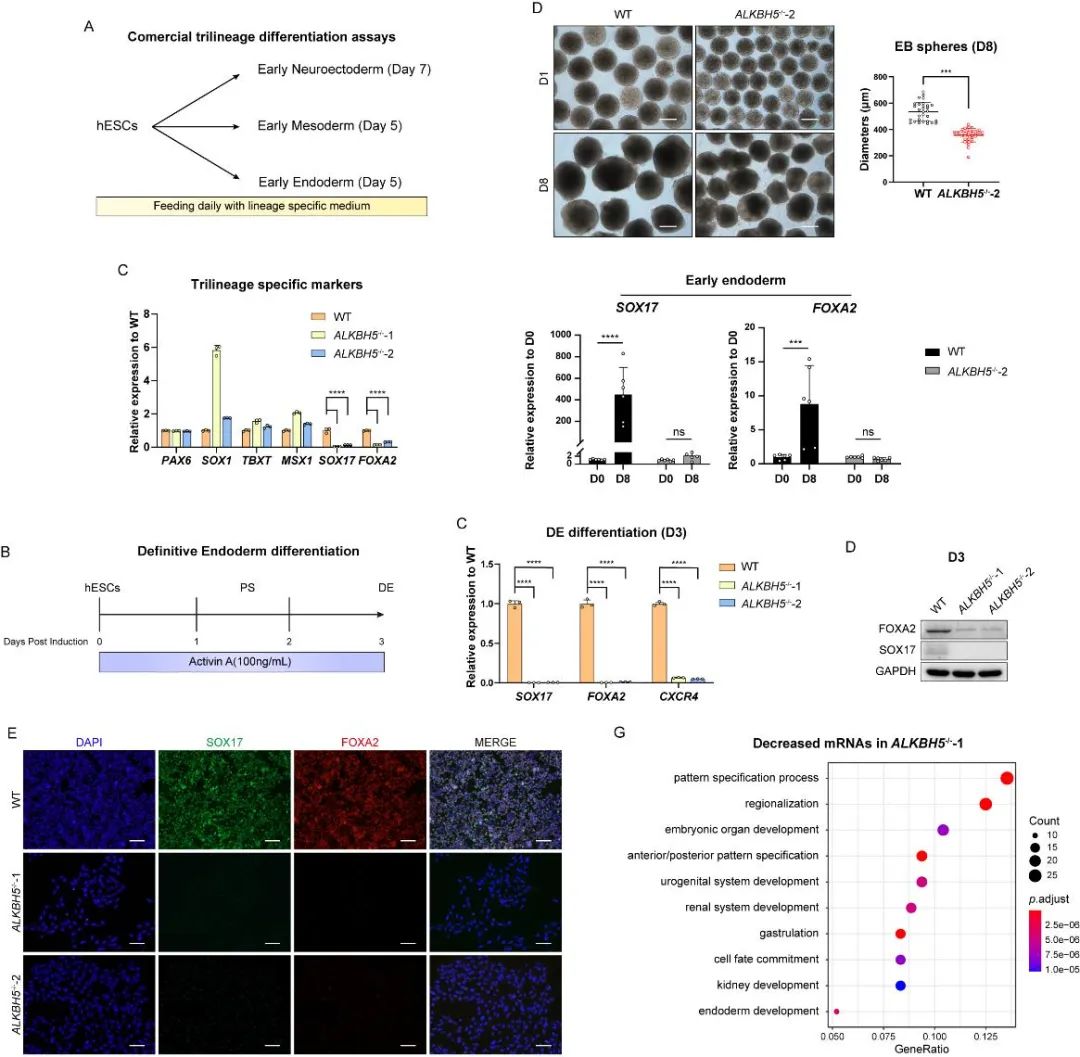
图1. ALKBH5敲除细胞无法正常分化为定形内胚层细胞
02. ALKBH5是内胚层形成过程中原条特化所必需的
在人胚胎干细胞分化为定形内胚层细胞之前,必须先经历一个向原条中间态细胞转变的过程,并随着原条前后端的建立,前段原条细胞会最终分化为定形内胚层细胞。为了准确地找到ALKBH5缺失阻碍内胚层发育的原因,研究人员需要确定ALKBH5具体影响了定形内胚层发育的哪个阶段。
通过time-course实验,研究人员在为期三天的定形内胚层分化过程中基本确定了36小时这个原条特化的时间点,并成功观测到从该时间点起ALKBH5敲除细胞在转录组模式上与野生型细胞开始出现显著差异,其原条和前端原条的特异性标志物均处于被严重抑制的状态。
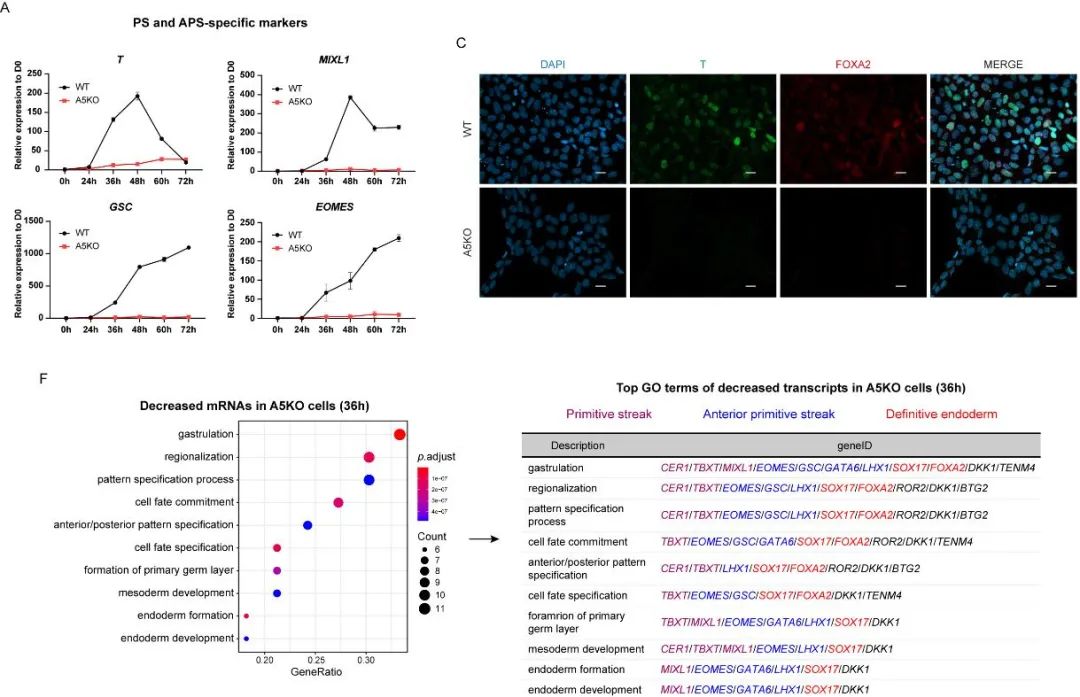
图2. ALKBH5的缺失严重抑制原条特化过程
03. GATA6转录本是ALKBH5的下游调控靶点
为探讨ALKBH5调控定形内胚层发育的分子机制,研究人员着眼于36小时这个最先出现显著转录水平差异的时间点,并通过该时间点样品的MeRIP-seq和RNA-seq的联合分析,寻找出在ALKBH5敲除后m6A峰值水平上升和RNA丰度下调的候选靶点。
结合回补实验验证,研究人员发现在这些候选靶点中只有GATA6的回补能够完全修复ALKBH5敲除细胞的定形内胚层分化障碍。同时,GATA6在人胚胎干细胞中的敲除也能够导致与ALKBH5缺失类似的定形内胚层分化缺陷,从功能上进一步验证了GATA6的转录本是ALKBH5在内胚层发育原条特化阶段中的下游靶点。
在ALKBH5如何调控GATA6转录本的问题上,研究人员基于GATA6的mRNA稳定性检测结果,推测并验证了m6A阅读器蛋白YTHDF2参与了由于ALKBH5缺失而呈现高甲基化的GATA6转录本的加速降解。

图3. ALKBH5下游靶点的鉴定和调控机制探索
04. ALKBH5-GATA6-DKK1/4-Wnt/β-catenin轴驱动定形内胚层的形成
研究人员通过CUT&Tag分析发现GATA6蛋白能够结合到许多经典Wnt通路调节因子的启动子区域。鉴于Wnt/β-catenin信号通路对原条发育的重要性,研究人员检测了经典Wnt通路激活的相关指标,并推测Wnt/β-catenin信号通路的阻断可能是ALKBH5敲除细胞无法向为定形内胚层分化的重要原因。
他们在这些与GATA6存在结合的经典Wnt通路调节因子中,意外地发现了两个典型的Wnt通路负向调控因子——DKK1和DKK4,与其他正向调节因子相比,它们在ALKBH5敲除后,Wnt/β-catenin信号通路受到抑制的情况下下调尤为明显,这与他们以往所报道的作用并不一致。
那么,DKK1和DKK4是否在ALKBH5-GATA6轴对Wnt/β-catenin信号通路调控的过程中扮演了某种未知的角色呢?借助DKK4和DKK1/4在人胚胎干细胞中的敲除以及后续的分化验证,研究人员观测到DKK1针对DKK4的敲除会产生一定的代偿效应,而DKK1/4的双基因敲除则同样会导致与ALKBH5敲除后类似的定形内胚层分化缺陷,且Wnt/β-catenin信号通路也处于无法激活的状态,由此可推断DKK1/4在该体系中对Wnt/β-catenin信号通路应该是起到正向调控的作用。
然而,DKK1/4的过表达回补并不能修复ALKBH5敲除所导致的定形内胚层发育缺陷。针对这一点,研究人员设计多种DKK1/4的回补方案以实现不同的回补剂量,并由此观测到只有接近于野生型表达量的DKK1/4回补剂量才能完全修复ALKBH5敲除细胞的内胚层分化缺陷。
基于以上结果,研究人员揭示了DKK1/4在该体系中对Wnt/β-catenin信号通路的调控作用具有明显的剂量依赖性,并总结了这两个DKK家族蛋白在不同剂量下的相应调控模式。
最后,研究人员根据经典Wnt通路激活剂Chir99021对ALKBH5敲除细胞内胚层分化缺陷的修复效果,进一步验证了Wnt/β-catenin信号通路的阻断是造成ALKBH5敲除细胞内胚层分化障碍的重要原因,也为ALKBH5-GATA6-DKK1/4-Wnt/β-catenin这条定形内胚层发育调控路线的提出提供了比较充分的证据。
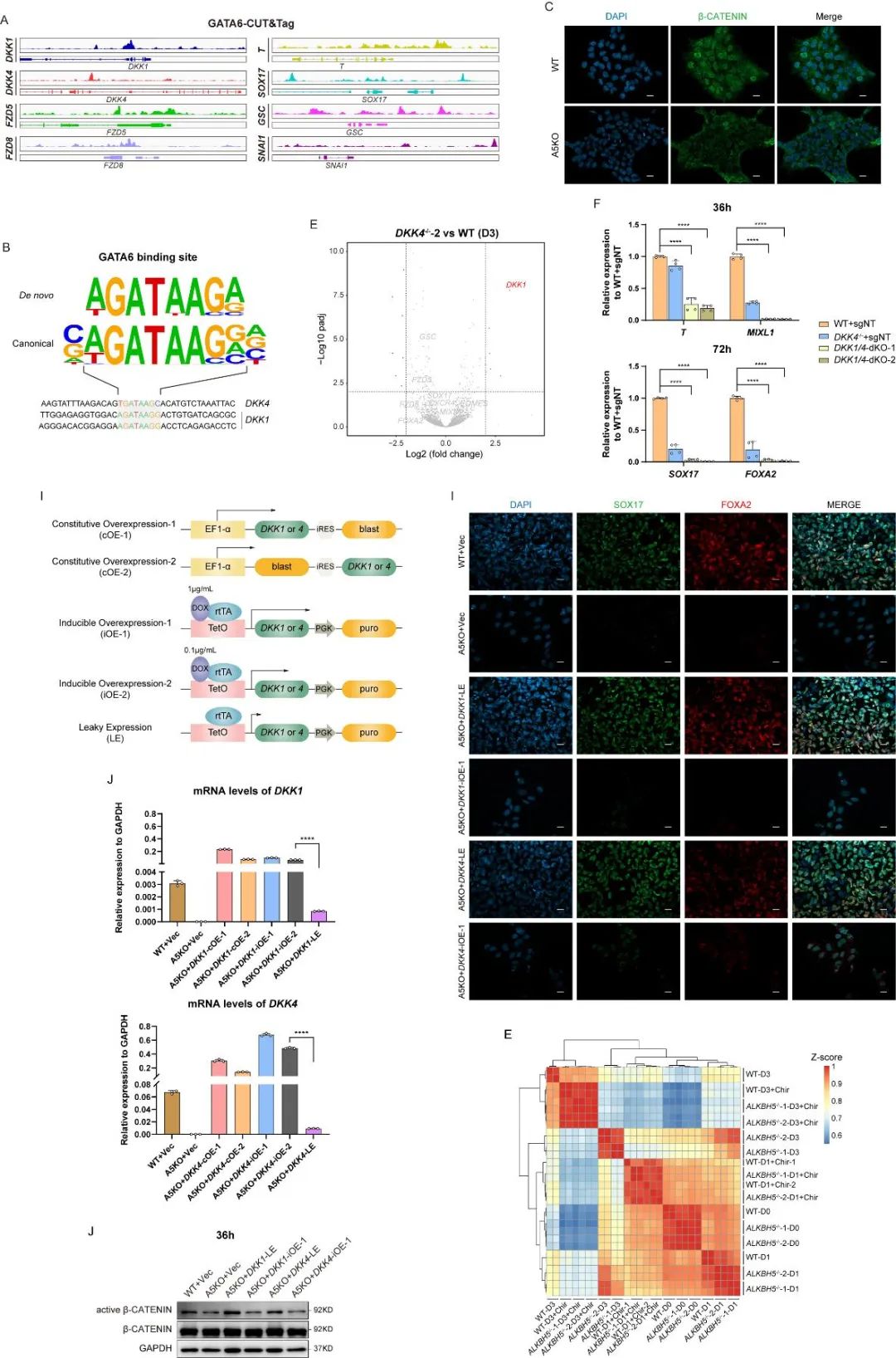
图4. DKK1/4对Wnt/β-catenin信号通路的调控作用具有剂量依赖性
总体而言,这项工作首次揭示了ALKBH5在人体外定形内胚层发育以及原条特化阶段的作用,并阐明了其潜在的分子机制,从而打破了人们以往对于ALKBH5和DKK1/4在胚胎发育或者信号调控作用上的固有认知,为今后m6A生物学的研究提供了新的启示和坚实的研究基础。
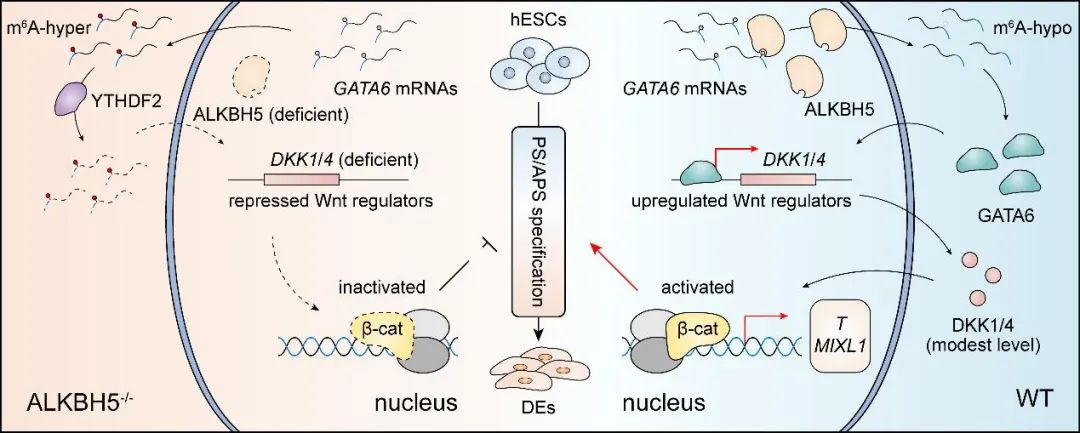
图5. ALKBH5-GATA6-DKK1/4-Wnt/β-catenin轴的调控示意图
西湖大学讲席教授裴端卿为本文的最后通讯作者,西湖大学助理研究员匡俊企为本文的共同通讯作者,西湖大学2020级博士研究生梁泽川为本文的第一作者。此外,其他参与本工作的裴端卿团队实验人员均为项目的稳定推进做出相当重要的贡献。本研究得到国家自然科学基金委和浙江省尖兵领雁项目的资助,并获得西湖大学生物医学实验技术中心和实验动物中心的大力支持。
最新资讯
人物故事
















