
搜索网站、位置和人员

生命科学学院 新闻动态
北京时间2024年3月1日,西湖大学雷凯团队在Cell Reports在线发表了题为“Neuromuscular organoids model spinal neuromuscular pathologies in C9orf72 amyotrophic lateral sclerosis”的研究成果。
该研究报道了一种利用患者诱导多能干细胞(induced pluripotent stem cells, iPSCs)构建神经肌肉类器官(Neuromuscular Organoids, NMOs)的方法,用于研究渐冻症(amyotrophic lateral sclerosis, ALS)的体外疾病模型。研究团队使用C9orf72突变的ALS患者的iPSCs,成功地诱导出NMOs。这些NMOs模拟了包括骨骼肌收缩障碍,神经肌肉接头退化和蛋白异常堆积等疾病相关的病理特征。同时,研究团队还展示了这种类器官模型对测试ALS治疗药物的功效。
该研究为进一步探索ALS的发病机制和治疗靶点提供了新的研究工具,为未来高通量筛选及个体化医疗提供了研究模型。实验室正在加速推进渐冻症转化医学研究,亟需具备细胞生物学、分子生物学、生物信息学、和高通量药物筛选经验的博士后、研究助理、博士研究生加盟,诚邀各方才俊、有志之士加入,携手共同成长。
文章链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00220-1
文章截图:

渐冻症即肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS),是一种多因素共同作用的神经退行性疾病,其主要特征是运动神经元的退行性改变。一般情况下,ALS患者的生存年限不超过两年,仅有10%的患者存活超过5年。目前已确定与ALS发病直接相关的基因有30多种,而家族性患者仅占总病例数的约10%。这些因素限制了小鼠等动物模型的开发,从而限制了ALS的机制研究与药物研发。因此,开发新的能模拟疾病表型且满足高通量筛选的体外疾病模型,对于ALS及其他神经退行性疾病的治疗手段的开发将起到巨大作用。

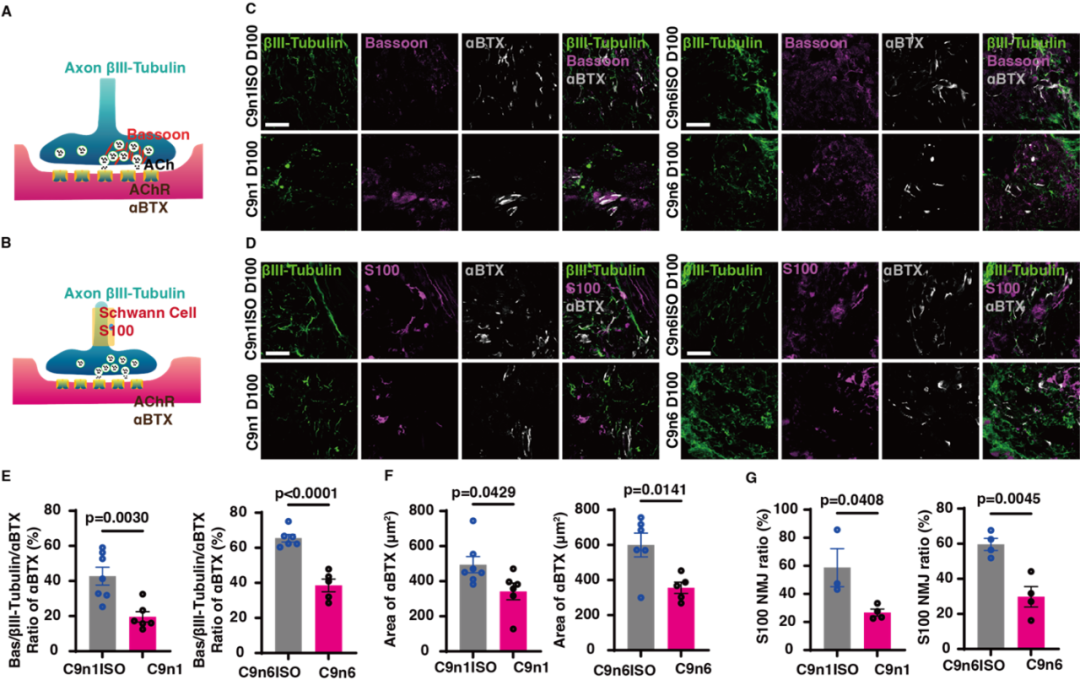

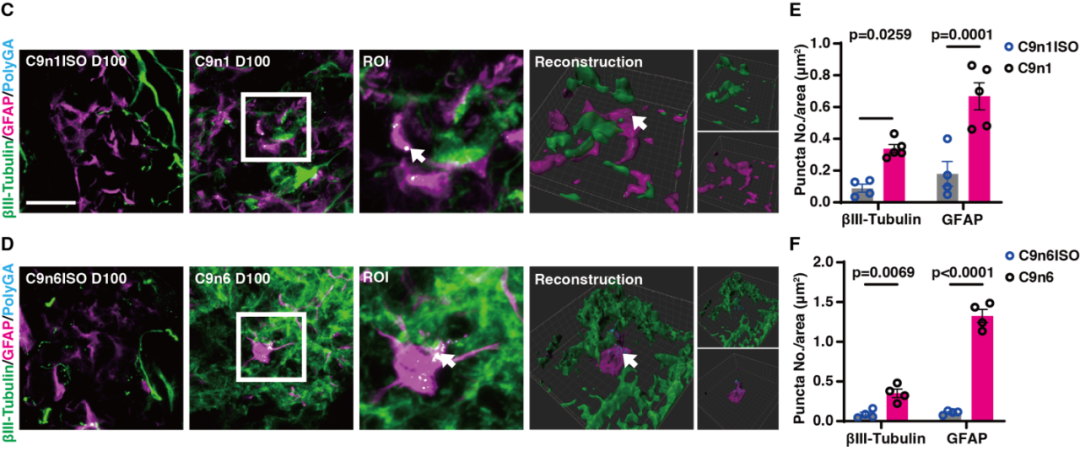

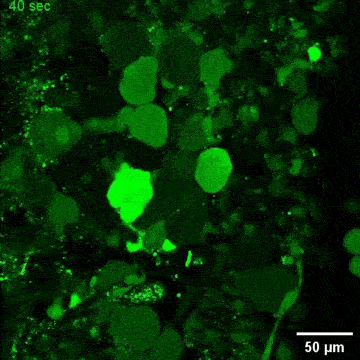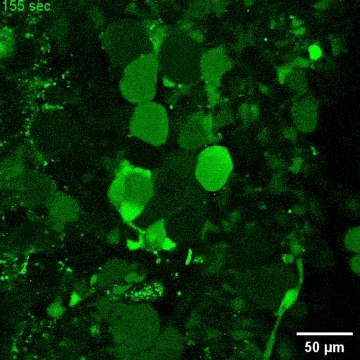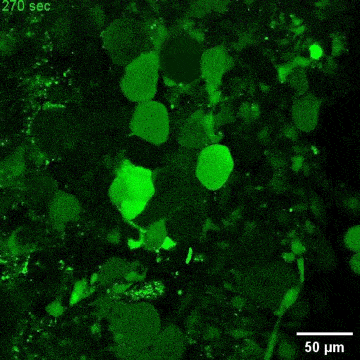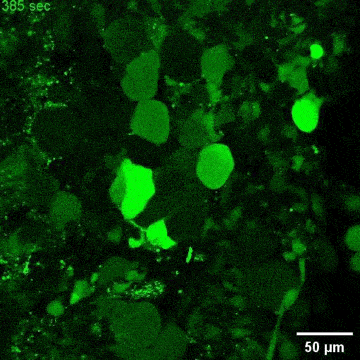
西湖大学生命科学学院的研究员雷凯为本文的通讯作者;原西湖大学博士后、现浙大城市学院副教授高充为本文的第一作者。其他合作者还包括西湖大学的石清华、潘雪、陈佳佳、文杉、张玉红、郎佳丽,西湖大学研究员刘晓东,复旦大学脑科学转化研究院研究员程田林;课题得到了浙江省“尖兵领雁+X”研发攻关计划、西湖实验室(生命科学和生物医学浙江省实验室)、国家自然科学基金,西湖大学教育基金会、上海市自然科学基金和科技计划项目的资助;项目实施还得到了西湖大学生物医学实验技术中心、西湖大学裴端卿实验室、常兴实验室、马丽佳实验室、南京医科大学刘妍实验室、德国柏林Max Delbrueck 分子医学中心Mina Gouti团队的支持与帮助。
西湖大学雷凯团队(https://en.westlake.edu.cn/faculty/kai-lei.html)致力于神经再生与干细胞生物学的研究,通过类器官、涡虫及小鼠模型,探索组织再生、神经退行性疾病及修复的分子机制与治疗靶点。本研究为进一步探索ALS的疾病机制、治疗靶点提供了新的研究工具,为未来高通量筛选及个体化医疗提供了研究模型。实验室正在加速推进渐冻症转化医学研究,亟需具备细胞生物学、分子生物学、生物信息学、和高通量药物筛选经验的博士后、研究助理、博士研究生加盟,诚邀各方才俊、有志之士加入,携手共同成长。(联系方式:lei_lab@westlake.edu.cn)
最新资讯
大学新闻

















